國家自然科學基金面上項目标書(shū)示例版
題目:真核起始因子X-Y軸調控糖基轉移酶對腸癌肝轉移的作用機制
摘要:
大(dà)腸癌術後複發轉移中(zhōng),肝、肺轉移是最常見的轉移模式,對其機制一(yī)直未能闡明。申請者在前期工(gōng)作中(zhōng)建立了大(dà)腸癌遠處轉移的特征分(fēn)子譜式,在肝轉移相關分(fēn)子标志(zhì)中(zhōng),發現真核起始因子Z家族的成員(yuán):X和Y具有關鍵調節作用。X-Y軸能夠介導大(dà)腸癌肝轉移的發生(shēng),X可促進細胞獲得運動能力,并且在轉移竈中(zhōng)通過Y的相互作用促進細胞異常增殖。進一(yī)步實驗證實,X能調節下(xià)遊糖基轉移酶,可能存在激活腸癌細胞膜表面半乳糖殘基,從而通過與肝細胞膜上特異性受體(tǐ)相互作用而使腸癌細胞“定居”于肝髒的機制,可見X-Y調節軸對于大(dà)腸癌肝轉移至關重要。本項目拟在此基礎上,從大(dà)樣本回顧性分(fēn)析中(zhōng)總結X-Y對于結腸癌肝轉移的臨床相關性和預後判斷價值。同時,在細胞和動物(wù)模型中(zhōng)進一(yī)步深入探讨其在結腸癌肝轉移調控中(zhōng)的作用方式和調控分(fēn)子機制,解析下(xià)遊效應途徑及靶點。
(一(yī))立項依據與研究内容(4000-8000 字):
一(yī)、立項依據
大(dà)腸癌是一(yī)種發生(shēng)在結腸或者直腸中(zhōng)的癌症,是最常見的惡性腫瘤之一(yī),全球每年新發病人約八百萬,占所有惡性腫瘤的10%-15%,其發病率和死亡率居惡性腫瘤的第三位[1]。随着手術、化療、放(fàng)療水平的提高,大(dà)腸癌患者的生(shēng)存率有了較大(dà)的提高,但遠處轉移是影響其預後的最主要因素。在美國大(dà)腸癌中(zhōng)有90%的死亡由腫瘤的遠處轉移所緻[2]。所以,通過對大(dà)腸癌轉移機制的研究,正确認識大(dà)腸癌術後轉移模式,對于制定合理的術後随訪方案,采取有針對性的幹預措施,提高生(shēng)存率至關重要。
大(dà)腸癌最常見的遠處轉移部位是肝髒和肺。對于肝轉移,人們更多的把原因歸結爲解剖因素,結腸是通過門靜脈系統回流進入肝髒,所以認爲大(dà)腸癌的首發轉移部位往往在肝髒。但是很多臨床研究發現大(dà)腸癌患者術後轉移可以繞開(kāi)肝髒而首先出現在肺部甚至是甲狀腺轉移[3-6],有報道出現首發肺轉移的大(dà)腸癌患者最高可達患者總數的6%,已經相當可觀[7],這就對我(wǒ)(wǒ)們的随訪策略提出挑戰,對于大(dà)腸癌患者即使術後沒有肝轉移,也不能放(fàng)松對肺部的檢查。而申請者在前期臨床研究中(zhōng),通過對本院486例行根治手術的大(dà)腸癌患者資(zī)料研究後發現:主要通過門靜脈系統回流的高位直腸癌和通過體(tǐ)循環回流的直腸中(zhōng)、低位直腸癌的術後肺轉移率和肝轉移率都沒有顯著性差異。由此可見,決定大(dà)腸癌的術後轉移模式的因素并非僅僅解剖可以闡釋。近年來研究發現包括原發腫瘤的分(fēn)期,術前放(fàng)化療,轉移靶器官的微環境等因素都會影響大(dà)腸癌的轉移模式[8-10],但其确切機制仍然沒有探明。
爲搜尋大(dà)腸癌遠端轉移相關分(fēn)子靶标并評估其作爲預測遠端轉移發生(shēng)的潛在分(fēn)子标志(zhì)物(wù)的可能性,我(wǒ)(wǒ)們前期在臨床上收集了6例珍貴的同時性肝、肺轉移分(fēn)别切除的患者,将其原發竈、肝、肺轉移的組織樣本通過高通量的基因芯片技術,從全基因表達譜的角度對這兩種轉移組織的基因表達情況進行了全方位的檢測分(fēn)析(來源于同一(yī)患者的組織樣本可以排除個體(tǐ)遺傳背景的幹擾)。我(wǒ)(wǒ)們發現:有41個基因在兩種大(dà)腸癌遠處轉移組織中(zhōng)存在顯著性差異(肝轉移分(fēn)子群有27個,肺轉移分(fēn)子群有14個),這些分(fēn)子可能構成了驅動大(dà)腸癌不同轉移模式的分(fēn)子因素。爲進一(yī)步确認芯片的結果,我(wǒ)(wǒ)們在47例大(dà)腸癌肝轉移和22例肺轉移組織病理樣本中(zhōng),通過qPCR的方式進行了回顧性驗證,确認了13個在大(dà)腸癌肝轉移過程中(zhōng)明顯高表達的基因(5倍以上),區别于肺轉移,這是一(yī)種特異性的表達改變(見前期工(gōng)作)。
這些肝轉移特異的分(fēn)子标志(zhì)中(zhōng),有兩個屬于真核起始因子Z家族的成員(yuán):X和Y,引起了我(wǒ)(wǒ)們的研究關注。Z真核起始因子在真核生(shēng)物(wù)翻譯起始過程中(zhōng)起着重要作用,參與了真核生(shēng)物(wù)翻譯起始過程中(zhōng)的多個反應[11],但其在腫瘤中(zhōng)的角色功能還尚不十分(fēn)清楚。我(wǒ)(wǒ)們首先鑒定了Y基因在大(dà)腸癌細胞中(zhōng)高表達,并确認Y表達被幹擾後,細胞增殖能力被顯著抑制,處于G1期的細胞數量顯減少,處于S期和G2期的細胞數量顯著增加,細胞凋亡比例顯著提高,細胞的存活能力顯著下(xià)降,克隆形成能力受到顯著抑制。這一(yī)結果已發表于《XXX》[12]。考慮到有報道X與Y之間存在相互結合[13-14],我(wǒ)(wǒ)們又(yòu)進一(yī)步觀察了兩者之間的交互作用。有意思的是,X對于Y的促惡性增殖功能是必需的,表現在沉默X表達之後,過表達Y對大(dà)腸癌細胞的增殖調控失活。而X本身具有調節細胞遷移的能力,抑制X可顯著降低細胞運動性(見前期工(gōng)作)。由此,我(wǒ)(wǒ)們提出科學假設:真核起始因子X-Y軸能夠調控大(dà)腸癌肝轉移的發生(shēng),X可介導細胞獲得運動能力,并且在轉移竈中(zhōng)調節Y發揮促進腫瘤細胞繼發性增殖的作用,具體(tǐ)作用機制有待闡明。
在哺乳動物(wù)中(zhōng),Z因子的亞基有8種,按分(fēn)子量從大(dà)到小(xiǎo)排列而命名[15]。Z因子參與真核細胞翻譯過程,而調節蛋白(bái)合成在維持細胞生(shēng)長控制中(zhōng)起重要作用[16]。據報道,Z因子不僅能通過促進mRNA與40s亞基結合,而且還可以獨自與遊離(lí)的40s亞基結合,影響40s亞基與60s亞基及其他亞基蛋白(bái)的結合或解離(lí)等[17]。Z家族成員(yuán)一(yī)般含有PCI和MPN結構域,這兩類結構域都參與蛋白(bái)-蛋白(bái)相互作用,部分(fēn)還具有RNA識别(RNA recognition motif,RRM)結構域,可能參與RNA的結合[15]。除此之外(wài),Z因子還被發現具有調控細胞周期的作用[16,18]。通過調節不同類型的mRNA的翻譯起始,Z因子就可以選擇性地調控蛋白(bái)的合成,從而對腫瘤細胞的生(shēng)長的轉移等生(shēng)物(wù)學行爲進行調控[16,19]。
Z家族中(zhōng)部分(fēn)成員(yuán)已證實在腫瘤的發生(shēng)、發展中(zhōng)扮演重要角色,已報道的包括:A、B、C、D等[18-22]。Y的緻癌作用由申請人首先報道,随後其在膠質瘤和呼吸系統腫瘤中(zhōng)的作用也被其他研究者發現 [12,23-25]。而關于X與惡性腫瘤的關系目前還未見文獻報道,可見在針對X、Y兩個分(fēn)子尤其是交互作用方面,申請人尚居于領先的研究地位。
更早前,權威雜(zá)志(zhì)J Biol Chem上的報道提示了X在包含Y蛋白(bái)的複合物(wù)與40S核糖體(tǐ)亞基結合的過程中(zhōng)扮演着關鍵的鏈接作用,缺失X時兩者的結合很不穩定,對翻譯起始系統的調節能力也會降低[26]。2013年9月,J Biol Chem上又(yòu)報道了W可與X競争性結合Y[27],從而形成不同的Z複合物(wù)。Z複合物(wù)負責招募tRNA或mRNA,可調節下(xià)遊基因表達,繼而影響腫瘤細胞的生(shēng)長、遷移等生(shēng)物(wù)學過程。不同的Z因子蛋白(bái)結合可能存在不同的翻譯調節機制從而執行不同功能作用。
在近期的研究工(gōng)作中(zhōng),申請人對X的調控機制進行了進一(yī)步深入。敲減X後,基因芯片檢測顯示腸癌細胞中(zhōng)多個關鍵調控節點發生(shēng)了改變。其中(zhōng),有3個半乳糖基轉移酶(β1,3-GalT; β1,4-GalT-1; β1,4-GalT-7)的表達降低了,這引起了我(wǒ)(wǒ)們的興趣。糖基化作爲常見的蛋白(bái)翻譯後修飾,參與細胞增殖、分(fēn)化、轉移、侵襲、免疫應答等多種生(shēng)命活動,糖基化紊亂能夠導緻多種腫瘤的發生(shēng)與惡性轉化,糖基轉移酶的表達和活性與包括大(dà)腸癌在内的多種腫瘤的惡性化程度相關[28-29]。Tang等發現β1,4-半乳糖基轉移酶1通過調節EGFR影響肝癌細胞的生(shēng)長和凋亡[30]。β1,4-半乳糖基轉移酶3通過調節整聯蛋白(bái)信号通路影響神經細胞瘤的侵襲能力[31]。此外(wài),半乳糖基轉移酶的激活,可以使細胞膜上蛋白(bái)糖基化程度增加[32]。
經過進一(yī)步腸癌細胞株的體(tǐ)外(wài)實驗驗證,X與半乳糖基轉移酶β1,4-GT-1和β1,4-GT1-7的表達正相關(見前期工(gōng)作),我(wǒ)(wǒ)們推測X對半乳糖基轉移酶的調節作用很可能是它在腸癌中(zhōng)介導腫瘤細胞肝轉移的關鍵。原因在于,肝細胞表面存在一(yī)種特異性表達的抗原:去(qù)唾液酸糖蛋白(bái)受體(tǐ)(asialoglycoprotein receptor, ASGPR),又(yòu)稱半乳糖受體(tǐ)。ASGPR是一(yī)種跨膜蛋白(bái),主要表達于哺乳動物(wù)肝窦狀隙的肝實質細胞表面,密度很高,每個細胞表面可多達500,000個受體(tǐ),其胞外(wài)結構域含有糖識别結構域,能識别和結合半乳糖殘基和N-乙酰半乳糖胺殘基[33]。Misawa等[34]曾經用神經氨酸酶處理骨髓細胞(Bone marrow cell,BMCs),使細胞膜表面的糖蛋白(bái)脫去(qù)唾液酸而暴露出半乳糖殘基,利用半乳糖殘基與ASGPR的相互作用使BMCs直接聚集到肝髒。我(wǒ)(wǒ)們相信,真核起始因子X在腸癌肝轉移的過程中(zhōng),可能調節下(xià)遊糖基轉移酶,存在一(yī)種通過激活腸癌細胞膜表面半乳糖殘基,從而與肝細胞膜上特異性受體(tǐ)ASGPR相互作用而使腸癌細胞“定居”于肝髒的機制,此後,它又(yòu)可介導Y的促進腫瘤細胞克隆化增殖的能力,最終形成肝組織腫瘤轉移竈。X-Y調節軸對于大(dà)腸癌肝轉移的内在調節機理是令人期待的。
在前期工(gōng)作基礎上,本項目拟從大(dà)樣本回顧性分(fēn)析中(zhōng)總結X-Y對于結腸癌肝轉移的臨床相關性和預後判斷價值。同時,在細胞和動物(wù)模型中(zhōng)進一(yī)步深入探讨其在結腸癌肝轉移調控中(zhōng)的作用方式和調控分(fēn)子機制:解析X調節半乳糖苷轉移酶表達的方式和作用靶點,明确其介導的信号通路,并确認X在Y複合物(wù)發揮功能的效應分(fēn)子途徑中(zhōng)的作用。以上研究在組織、細胞、動物(wù)三個層次展開(kāi),并通過分(fēn)子機制研究進行縱向的突破,以期獲得高水平的研究成果。
本項目是對結腸癌肝轉移發生(shēng)機制的研究深入,所獲得的研究成果可幫助我(wǒ)(wǒ)們更好判斷腸癌預後,通過肝轉移特征性的分(fēn)子标志(zhì),提示風險,并爲相關靶點應用于臨床轉化醫學奠定理論基礎。
主要參考文獻
因涉敏感基因信息,略
二、項目的研究内容、研究目标,以及拟解決的關鍵科學問題
1、研究内容
1) 回顧性檢測500例腸癌患者手術标本中(zhōng)X和Y蛋白(bái)的表達水平,根據臨床病理數據和随訪數據多因素分(fēn)析X、Y表達與腸癌肝轉移發生(shēng)的相關性,嘗試建立基于X、Y表達的分(fēn)子預測模型,評價這一(yī)預後指标的臨床适用價值。
2) 在腸癌細胞株中(zhōng)過表達和沉默X、Y基因,觀察細胞功能變化。在細胞實驗基礎上,應用裸鼠成瘤和肝轉移動物(wù)模型進行驗證,觀察X、Y對于腸癌惡性增殖和轉移發生(shēng)的影響。結合細胞、動物(wù)和組織水平的研究數據闡明X、Y在腸癌發生(shēng)、進展中(zhōng)的功能作用。
3) 根據前期工(gōng)作的下(xià)遊通路和靶分(fēn)子分(fēn)析結果,重點闡明:①X與糖基轉移酶之間的調控關系和作用靶點;②X與細胞運動性信号通路靶分(fēn)子的調節關系;③Y複合物(wù)調節的信号通路與效應分(fēn)子;④X與Y相互結合的序列位點和精細調控。
2.研究目标及考核的技術指标
基于Y在腸癌細胞高表達能促進細胞惡性增殖和周期改變,X與Y之間存在相互結合,而X具有調節細胞遷移的能力,申請者的研究目标在于證實X-Y軸能夠調控大(dà)腸癌肝轉移的發生(shēng),X可介導細胞獲得運動能力并在轉移竈中(zhōng)調節Y發揮促進腫瘤細胞繼發性增殖的作用。而在體(tǐ)内、體(tǐ)外(wài)明确其促肝轉移功能作用基礎上,X調控結腸癌細胞遷移的分(fēn)子機制通過以下(xià)兩個目标進行深入探讨:
1) 闡明Y複合物(wù)調節的信号通路與效應分(fēn)子;
2) 确認X與Y相互結合的序列位點和精細調控;
3)探讨X調節大(dà)腸癌肝轉移模式的具體(tǐ)作用機制。
3.拟解決的關鍵科學問題及其解決方法
本課題所需解決的第一(yī)個關鍵科學問題爲X和Y在大(dà)腸癌肝轉移中(zhōng)的臨床意義,通過大(dà)樣本組織中(zhōng)檢測這兩個分(fēn)子的表達,并利用病理和随訪數據進行統計分(fēn)析,我(wǒ)(wǒ)們可以獲得多因素條件下(xià)這兩個靶标的臨床價值。這其中(zhōng),規範化的組織樣本庫,随訪數據的積累以及統計方法的運用都是重要的影響因素,但申請者所在課題組在這方面從事過多個課題的研究,具有豐富經驗。另一(yī)方面,這兩個靶标的檢測有成熟的商(shāng)業化抗體(tǐ),方法學上也不存在困難。
本課題第二個關鍵問題也是本課題研究的重點,即X-Y軸在大(dà)腸癌肝轉移中(zhōng)的調控分(fēn)子機制,我(wǒ)(wǒ)們需要闡明Y所介導的遷移功能及糖基轉移酶信号途徑的效應分(fēn)子和作用方式,并且确認Y與X結合的精細調控及促進腫瘤細胞增殖的分(fēn)子機制。這方面的工(gōng)作依賴于紮實的前期工(gōng)作,首先,我(wǒ)(wǒ)們已經得到Y和X沉默後功能表型的結果,即Y可調控細胞增殖,而X能夠調節細胞遷移,并影響Y對腫瘤的促增殖作用,在此基礎上做機制研究有的放(fàng)矢。其次,我(wǒ)(wǒ)們已篩查和驗證到X可通過調節兩個糖基轉移酶對腸癌細胞肝髒種植起到調節作用,在本課題中(zhōng),我(wǒ)(wǒ)們需要深入做的工(gōng)作是揭示X如何調節細胞遷移功能,其下(xià)遊調節糖基轉移酶是否與肝髒特異性的轉移相關,以及它們具體(tǐ)的作用機制是怎樣的。在邏輯清晰的機制通路假設中(zhōng),我(wǒ)(wǒ)們隻需逐條驗證,即可真正揭開(kāi)X作用通路的神秘面紗。最後,Y和X之間的cross-talk有創新性且立足于前期研究的數據支持,隻需将X-Y複合物(wù)調節的位點和下(xià)遊與細胞增殖功能相關的機制闡釋清楚,即可形成完成的研究故事。考慮到腫瘤細胞增殖機制方面報道衆多,可參考模式豐富,這方面的研究也不會有太大(dà)的科學風險。
三、拟采取的研究方法、技術路線、實驗方案及可行性分(fēn)析
1. 技術路線
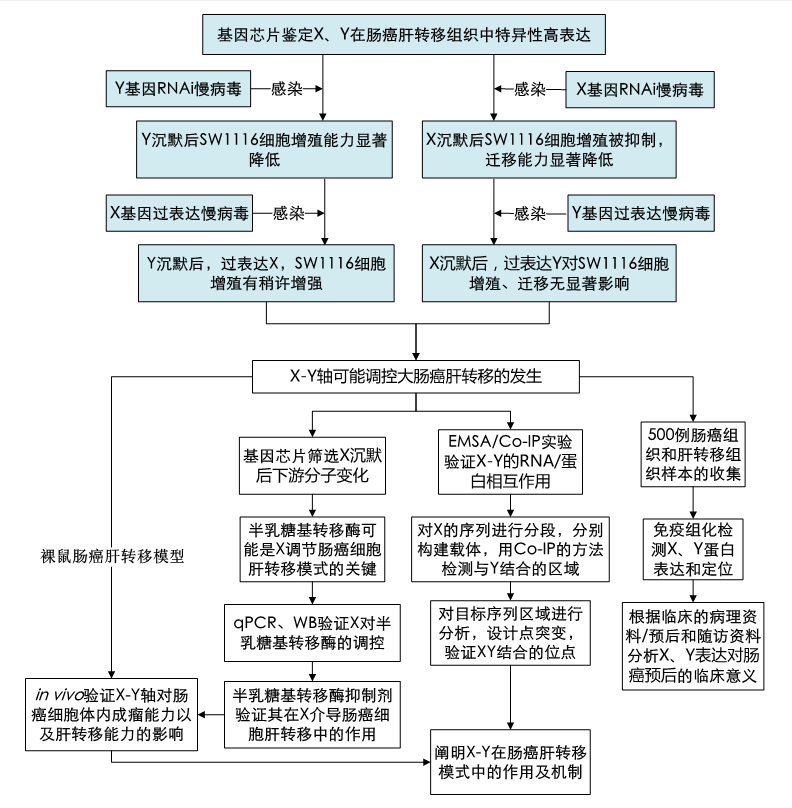
備注:藍(lán)色背景填充部分(fēn)爲前期已完成工(gōng)作。
2. 研究方法
2.1 X、Y在結腸癌發生(shēng)、發展中(zhōng)的作用和預後相關性
1) 回顧性收集腸癌臨床标本500例,取手術切除的腸癌組織、匹配的肝髒轉移竈手術和穿刺标本,新鮮組織液氮保存标本200例,石蠟塊300例,全部病例均通過臨床、影像學、病理診斷,術前未進行輔助治療,來自某某醫院2008-2013年臨床收治病例,随訪資(zī)料齊全。
2) 免疫組化檢測組織切片中(zhōng)X、Y蛋白(bái)的表達及定位,分(fēn)别設立陰性對照、腫瘤對照、肝轉移對照。
3) SPSS16.0統計軟件對X、Y表達及定位與臨床标本進行病理關聯性分(fēn)析和預後統計分(fēn)析,了解X、Y表達情況與相關臨床資(zī)料之間的關系,單因素生(shēng)存分(fēn)析對臨床各項指标與結腸癌生(shēng)存期進行相關性分(fēn)析,建立Cox比例風險回歸模型,綜合探讨臨床各因素和X、Y表達與結腸癌肝轉移、轉移竈形成及預後的相關性。
2.2 體(tǐ)外(wài)、體(tǐ)内水平研究X、Y基因在腸癌肝轉移中(zhōng)的調節功能
1) 制備X-shRNA慢(màn)病毒,建立X穩定沉默的細胞株,以無義序列作爲陰性對照,利用MTT實驗觀察X沉默後細胞的生(shēng)長曲線;克隆形成實驗檢測X沉默後細胞的克隆形成能力;流式細胞術結合PI單染、Annexin-V雙染檢測細胞周期和凋亡情況;細胞劃痕實驗、Transwell實驗觀察細胞運動能力的變化。與此同時,制備過表達X的慢(màn)病毒載體(tǐ)。
2) 在穩定沉默X的結腸癌細胞中(zhōng),導入過表達Y的慢(màn)病毒載體(tǐ),利用細胞生(shēng)長曲線觀察X沉默且Y過表達後細胞的增殖能力變化;細胞劃痕實驗、Transwell實驗觀察細胞運動能力的變化。同樣地,在穩定沉默Y的結腸癌細胞中(zhōng),導入過表達X的慢(màn)病毒載體(tǐ),利用細胞生(shēng)長曲線觀察Y沉默&X過表達後細胞的增殖能力變化;細胞劃痕實驗、Transwell實驗觀察細胞運動能力的變化。
3) 制備結腸裸鼠皮下(xià)移植瘤模型,觀察腫瘤生(shēng)長情況,建立生(shēng)長曲線,統計分(fēn)析Y和X對結腸癌細胞體(tǐ)内成瘤能力的影響,明确Y和X在結腸癌惡性增殖的作用。實驗分(fēn)組:空白(bái)對照、Y沉默組、X沉默組、X沉默組+Y過表達組、Y沉默組+X過表達組。
4) 建立結腸癌肝轉移動物(wù)模型,觀察肝髒中(zhōng)的轉移竈,統計分(fēn)析Y和X對結腸癌肝轉移能力的影響,明确Y和X在結腸癌肝轉移過程中(zhōng)的作用。實驗分(fēn)組:空白(bái)對照、Y沉默組、X沉默組、X沉默組+Y過表達組、Y沉默組+X過表達組。
5) 處死裸鼠取得的腫瘤組織,利用qRT-PCR和免疫組化方法檢測Y/X以及下(xià)遊半乳糖苷酶的mRNA和蛋白(bái)的表達;部分(fēn)腫瘤組織制備成冰凍切片,利用FITC和TRITC雙标記免疫熒光染色,使用激光共聚焦顯微鏡觀察X與Y的共定位情況。
2.3. X-Y軸調節結腸癌肝轉移的分(fēn)子機制研究
1) 通過基因芯片Microarray分(fēn)析X過表達/沉默後基因表達譜變化情況,對原始數據進行歸一(yī)化、标準化,差異表達分(fēn)析,明确X消減後表達發生(shēng)改變的下(xià)遊調控分(fēn)子,芯片結果中(zhōng)有顯著差異的潛在作用分(fēn)子,設計引物(wù),通過qRT-PCR進行二次表達驗證。
2) X基因過表達/沉默後發生(shēng)顯著表達差異的基因,利用Bayesian Network、Genes2Networks、Go-anaslysis軟件進行signaling network 重建。解析X調控結腸癌細胞運動能力的信号通路網絡,構建X爲核心的信号分(fēn)子網絡。
3) 根據X基因沉默後影響的信号通路結果(半乳糖基轉移酶及其上遊調節信号通路),利用信号通路抑制劑處理X穩定過表達/沉默後結腸癌細胞和對照細胞,檢測不同分(fēn)子信号對X表達及功能的作用,驗證阻斷這些信号通路後對X在結腸癌中(zhōng)的功能表型的影響。
4) 采用信号通路高通量檢測蛋白(bái)芯片,根據以上實驗分(fēn)析的通路情況,訂購相應通路的Pathway Array試劑盒,按試劑盒操作,依據封閉、加入細胞裂解液、洗脫、加入抗體(tǐ)混合液、再次洗脫,加入辣根過氧化物(wù)酶HRP并洗脫、信号檢測的步驟,檢測X基因表達變化後的特定通路關鍵蛋白(bái)的變化。
5) 分(fēn)别構建X、Y的真核表達載體(tǐ),共轉293T,通過免疫共沉澱(Co-IP)驗證XY的相互結合作用。
6) 應用生(shēng)物(wù)信息學技術模拟X與Y的結合位點。在結合位點制備不同氨基酸的突變體(tǐ)。采用RNAi方法敲減互作蛋白(bái)表達,接着轉入互作蛋白(bái)的突變體(tǐ),檢測細胞功能表型變化。通過免疫共沉澱(Co-IP)驗證X與Y之間的結合位點特異性。
7) EMSA實驗驗證X與Y之間的相互作用關系,參考蛋白(bái)相互作用實驗,設計突變載體(tǐ),再驗證其結合特異性,由此揭示X作爲Y調節蛋白(bái)其對下(xià)遊RNA進行調控的精細機制。
3. 可行性分(fēn)析
1) 研究目标切實可行:我(wǒ)(wǒ)們前期的工(gōng)作已明确證實:Y可以調節結腸癌的惡性增殖,并且進行了大(dà)量的預實驗,可支持本課題主要科學假設。本項目是對前期研究工(gōng)作的進一(yī)步補充和完善,具有較好的可行性。
2) 技術平台與硬件設施完善:課題組成員(yuán)長期從事結直腸癌的診治和發生(shēng)發展機制研究,在免疫組化、免疫印迹、實時熒光定量PCR、RNA 幹擾、慢(màn)病毒包裝、表達譜芯片研究等各個方面積累了大(dà)量的經驗,本項目中(zhōng)所用到的實驗技術以前均有所涉及,爲本項目的實施提供了技術保障。本項目所需的主要儀器設備目前均已經具備。
3) 研究基礎紮實:本課題組成員(yuán)長期從事結直腸癌的基礎和臨床研究,具有良好的科研素質。在國内外(wài)雜(zá)志(zhì)上發表了多篇結直腸癌基礎研究和臨床研究相關的論文。
4) 臨床标本充足:仁濟醫院普外(wài)科長期從事結直腸癌的診治,已經建立一(yī)套規範化的結直腸癌診療體(tǐ)系,擁有大(dà)量結直腸癌手術标本(每年1000餘例),能夠保證課題所需大(dà)量的結直腸癌标本的要求。
5) 團隊年輕優秀、成員(yuán)配備合理:課題組成員(yuán)大(dà)部分(fēn)爲中(zhōng)青年業務骨幹,熱愛科學研究,有較強的創新能力,能爲實驗投入大(dà)量的時間,每個人均有自己的研究專長,能保障本實驗的順利完成。
4. 本項目的特色與創新之處
1) 思路上創新:X和Y是Z家族中(zhōng)具有相互作用的一(yī)對分(fēn)子,他們在結腸癌肝轉移的過程中(zhōng)發揮差異性的功能。針對X-Y軸進行組合策略研究,能夠解決更多維度的科學問題,對臨床具有指導意義;
2) 内容上創新:X-Y軸在結腸癌癌中(zhōng)的功能作用和與癌變的關系還是未知(zhī)領域,我(wǒ)(wǒ)們首先鑒定了Y,随後對Y和X的交互作用進行研究,能夠進一(yī)步形成創新的研究成果。
5. 研究工(gōng)作的進度安排
本項目預計在4年内完成,具體(tǐ)進展計劃如下(xià):
u 2015.01-2015.12:定量PCR檢測結腸癌及結腸癌肝轉移新鮮組織标本中(zhōng)X和Y表達,分(fēn)析臨床病理及預後的相關性;X和Y基因過表達和shRNA慢(màn)病毒構建、包裝和純化,細胞功能檢測;
u 2016.01-2016.12:免疫組化檢測結腸癌及結腸癌肝轉移标本中(zhōng)Y和X表達,分(fēn)析臨床病理及預後的相關性;X和Y影響結腸癌肝髒轉移和惡性增殖的動物(wù)實驗。
u 2017.01-2017.12:Pathway array分(fēn)析X和Y調控結直腸癌細胞轉移的信号通路網絡;生(shēng)物(wù)信息學分(fēn)析與分(fēn)子驗證,通路抑制劑驗證。
u 2018.01-2018.12:Co-IP實驗驗證X與Y之間的相互作用關系。蛋白(bái)結合位點突變載體(tǐ)制備及其結合特異性驗證。
6. 預期研究結果
1)闡明X和Y表達在腸癌中(zhōng)的臨床意義;
2)解析X-Y調節軸在結腸癌肝轉移中(zhōng)的功能及相互作用機制;
3)在國際學術刊物(wù)上發表SCI收錄學術論文3篇,至少1篇IF>5;
4)申請專利1項;
5)培養博士研究生(shēng)1名,碩士研究生(shēng)2名。
三、工(gōng)作基礎
因涉敏感基因信息,略
微環DNA表達雙靶向抗體(tǐ)的癌症免疫治療技術成爲繼CAR-T技術(“嵌合抗原受體(tǐ)T細胞免疫療法”)、TIL技術(“腫瘤滲潤淋巴細胞技術)、免疫檢查點抑制劑等技術之後又(yòu)一(yī)項獲得成功的新一(yī)代治療技術。
